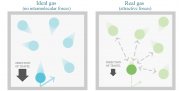
ما دو نوع گاز داریم: گاز ایده آل(کامل) و گاز حقیقی(غیرایده آل).
گاز ایده آل گازی است که نیروهای بین مولکولی (چه دافعه و چه جاذبه) در آن قابل چشم پوشی است و نیز بین فشارP، حجمV، دمای کلوینT و مقدار مولn آن رابطه زیر برقرار است: PV=nRT (که داریم R=8.314 پاسکال.مترمکعب بر مول.کلوین یا R=0.082 لیتر.اتمسفر بر مول.کلوین)
گاز کامل دقیقاً همان گاز ایده آل است.
گاز حقیقی چیست؟ گازهایی که از رابطه PV=nRT تبعیت نمیکنند، گازهای غیرایده آل یا گازهای حقیقی نامیده میشوند.
هر گازی در فشارهای زیاد و دماهای کم غیر ایده آل می شود و هرچه فشار بیشتر و دما کمتر شود میزان این عدم ایده آلی در گاز بیشتر می شود. (یعنی میزان انحراف گاز از معادله PV=nRTبیشتر می شود)
درباره گازهای حقیقی دو نوع انحراف از گاز ایده آل وجود دارد: وقتی جاذبه ها مهم و غیرقابل چشم پوشی است (یعنی در فشارهای نسبتاً زیاد) و وقتی دافعه بین ذرات مهم و غیرقابل چشم پوشی است (در فشارهای بسیار بسیار زیاد مثلاً چند صد اتمسفر).
همانطور که گفته شد در فشارهای خیلی کم نیز، گاز تقریباً ایده آل است.
پی نوشت: البته در تعریف دقیقتر گاز ایده آل و گاز کامل گفته می شود که گاز ایده آل بایستی PV=nRT را رعایت کند و گاز کامل گازی است که اولاً ایدهآل باشد، ثانیاً نیروهای بین مولکولی در آن قابل چشمپوشی باشد. در شیمی فیزیک به سادگی اثبات می شود که گاز ایده آل و گاز کامل دقیقاً یکی هستند.
مشاوره جهت کلاس شیمی
با برنده مدال طلای المپیاد شیمی و استاد کنکور
- شما میتوانید جهت مشاورۀ شرکت در کلاسهای شیمی کنکور، تقویتی و المپیاد شیمی با برندۀ مدال طلای المپیاد شیمی به صورت مستقیم در تماس باشید!
- فقط در تلگرام: HosseinZamaninasab@
مشاوره رایگان است!







سلام مرسی از سایت خوبتون
یه سوال داشتم چرا دما سنجی که با گاز کامل درست شده دقیق ترین دماسنجه؟؟؟
سلام چون از معادله حالت تبعیت میکنه و نیروهای بین مولکولی همیشه قابل چشم پوشی است پس این دما سنج تمام انرژی که از محیط (دما) جذب میکنه رو صرف تغییر ارتفاع(فشار) میده و چیزی ازین انرژی صرف غلبه نیروهای بین مولکولی نمیشه پس دقیق ترین دماسنجه